viernes, 17 de abril de 2015
Minuta de los Elementos Toxicos
Muchos
de los productos y artículos presentes en los hogares contienen y
liberan sustancias tóxicas que pueden dañar nuestra salud. Estas
sustancias están presentes en materiales de construcción y decoración,
aislantes, pinturas, recubrimientos, plásticos, productos de limpieza,
pesticidas domésticos, ambientadores, productos de aseo e higiene
personal, agua del grifo, alimentos… y otras cosas presentes en las
casas.
.
Son sustancias que innumerables estudios científicos han asociado a problemas de salud muchas veces a niveles muy bajos de concentración, semejantes a aquellos a los que de hecho son encontradas en muchos hogares, por ejemplo en el polvo doméstico. Entre estas sustancias se cuentan algunas pertenecientes a grupos como los ftalatos, retardantes de llama, compuestos perfluorados… o como, entre otras muchas, los compuestos orgánicos volátiles (formaldehído, benceno, tolueno…) que pueden ser inhaladas en el interior de los hogares.
Son sustancias que innumerables estudios científicos han asociado a problemas de salud muchas veces a niveles muy bajos de concentración, semejantes a aquellos a los que de hecho son encontradas en muchos hogares, por ejemplo en el polvo doméstico. Entre estas sustancias se cuentan algunas pertenecientes a grupos como los ftalatos, retardantes de llama, compuestos perfluorados… o como, entre otras muchas, los compuestos orgánicos volátiles (formaldehído, benceno, tolueno…) que pueden ser inhaladas en el interior de los hogares.
La contaminación química en el hogar
es un grave problema de salud pública ante el que es necesaria una
respuesta inmediata, sobre todo teniendo en cuenta que la población
occidental pasa de media cerca de un 90% de su tiempo en espacios
cerrados, mucho del cual es en el propio domicilio.
En la práctica, es muy poco lo que se está haciendo para proteger a
la población, especialmente para proteger a sectores más vulnerables a
este problema tales como las mujeres embarazadas o los niños. Este grave
problema ha sido causado fundamentalmente por el ineficiente control
que ha prevalecido en el ámbito del diseño y comercialización de las
sustancias químicas.
martes, 14 de abril de 2015
Propiedades del fósforo
Una de las propiedades de los
elementos no metales como el fósforo es por ejemplo que los elementos no
metales son malos conductores del calor y la electricidad.
El fósforo, al igual que los demás elementos no metales, no tiene
lustre.
Debido a su fragilidad, los no metales como el fósforo, no se pueden
aplanar para formar láminas ni estirados para convertirse en hilos.
El estado del fósforo en su forma natural es sólido (diamagnético).
El fósforo es un elmento químico de aspecto incoloro, rojo o blanco plateado y pertenece al grupo de los no metales.
El número atómico del fósforo es 15.
El símbolo químico del fósforo es P.
El punto de fusión del fósforo es de 317,3 grados Kelvin o de 45,15 grados celsius o grados centígrados.
El punto de ebullición del fósforo es de 550 grados Kelvin o de 277,85 grados celsius o grados centígrados.
El fósforo es un mineral que nuestro organismo necesita para su correcto funcionamiento y se puede encontrar en los alimentos.
A través del siguiente enlace, podrás encontrar una lista de alimentos con fósforo.
Usos del fósforo
El fósforo es un elemento químico importante que tiene sólo un isótopo estable.
Si alguna vez te has preguntado para qué sirve el silicio, a continuación tienes una lista de sus posibles usos:
- Los fosfatos se utilizan para hacer vidrio especial que se utiliza como en las lámparas de sodio.
- El fósforo es un nutriente esencial para las plantas, por lo que se añade a los fertilizantes.
- En el laboratorio, dos isótopos radiactivos de fósforo se puede utilizar como trazadores radiactivos.
- El fosfato de calcio se puede utilizar para hacer porcelana fina.
- Las cabezas de las cerillas están hechos de fósforo. Las bengalas y los fósforos de seguridad también están hechos de fósforo.
- El fósforo blanco se usa en bombas incendiarias, cortinas de humo (por ejemplo, bombas de humo) y en munición trazadora.
- El tributilfosfato, un compuesto de fósforo, se utiliza para extraer uranio. Esto se llama el proceso Purex.
- El fósforo es un componente importante de ADN y ARN.
- El fósforo se utiliza en la producción de acero.
- El tripolifosfato de sodio se utiliza en detergentes para ropa en algunas partes del mundo. Esto ayuda en la limpieza de la ropa. Sin embargo, algunos países han prohibido ya que conduce a la muerte de los peces cuando se filtró hacia las vías fluviales.
- Otros compuestos de fósforo se utilizan en la fabricación de pesticidas, aditivos alimentarios, dentífrico y fertilizantes.
Propiedades del hidrógeno
Una de las propiedades de los
elementos no metales como el hidrógeno es por ejemplo que los elementos
no metales son malos conductores del calor y la electricidad.
El hidrógeno, al igual que los demás elementos no metales, no tiene
lustre.
Debido a su fragilidad, los no metales como el hidrógeno, no se pueden
aplanar para formar láminas ni estirados para convertirse en hilos.
El estado del hidrógeno en su forma natural es gaseoso.
El hidrógeno es un elmento químico de aspecto incoloro y pertenece al grupo de los no metales.
El número atómico del hidrógeno es 1.
El símbolo químico del hidrógeno es H.
El punto de fusión del hidrógeno es de 14,025 grados Kelvin o de -258,125 grados celsius o grados centígrados.
El punto de ebullición del hidrógeno es de 20,268 grados Kelvin o de -251,882 grados celsius o grados centígrados.
Usos del hidrógeno
El hidrógeno es un elemento químico con número atómico 1. Por lo
general se coloca en la esquina superior izquierda de la tabla
periódica. Mucha gente me pregunta '¿cuáles son algunos de los usos
comunes de hidrógeno?
Si alguna vez te has preguntado para qué sirve el hidrógeno, a continuación tienes una lista de sus posibles usos:
- Se utiliza para el procesar combustibles fósiles.
- Se utiliza para producir amoníaco utilizado en los productos comunes de limpieza del hogar.
- El hidrógeno se utiliza como un agente hidrogenante para producir metanol y convertir aceites y grasas no saturada insalubres en aceites y grasas saturadas.
- El punto triple del hidrógeno (la temperatura a la que los 3 estados, sólido, líquido y gaseoso están en equilibrio) puede utilizarse para calibrar algunos termómetros.
- El tritio, un isótopo radioactivo de hidrógeno, se produce en las reacciones nucleares. Se puede utilizar para fabricar bombas de hidrógeno y actúa como una fuente de radiación en pinturas luminosas. En las ciencias biológicas, el tritio se utiliza a veces como un marcador isotópico.
- El hidrógeno (ya sea utilizado por sí solo o combinado con nitrógeno) se utiliza en plantas de fabricación de muchos para determinar si hay fugas. También se utiliza para detectar fugas en los envases de alimentos.
- El hidrógeno se utiliza como refrigerante rotor en generadores eléctricos.
- El hidrógeno en estado gaseoso se usa como un gas de protección en la soldadura de hidrógeno atómico.
- También se usa en la producción de ácido clorhídrico, utilizado ampliamente en las industrias químicas.
- El gas de hidrógeno se utiliza para reducir muchos minerales metálicos.
- Puede ser utilizado para crear agua.
Propiedades del bromo
Los elementos del grupo de los halógenos como el bromo se presentan como moléculas diatómicas químicamente activas.
El nombre halógeno, proviene del griego y su significado es "formador de sales".
Son elementos halógenos entre los que se encuentra el bromo, son oxidantes.
Muchos compuestos sintéticos orgánicos y algunos compuestos orgánicos naturales, contienen elementos halógenos como el bromo.
A este tipo de compuestos se los conoce como compuestos halogenados.
El estado del bromo en su forma natural es líquido, muy móvil y
volátil.
El bromo es un elmento químico de aspecto gas o líquido: marrón rojizo
Sólido: metálico lustroso y pertenece al grupo de los halógenos.
El número atómico del bromo es 35.
El símbolo químico del bromo es Br.
El punto de fusión del bromo es de 265,8 grados Kelvin o de -6,35 grados
celsius o grados centígrados.
El punto de ebullición del bromo es de 332 grados Kelvin o de 59,85
grados celsius o grados centígrados.
Usos del bromo
El bromo es un elemento químico que pertenece al grupo de los halógenos.
El bromo elemental es un líquido marrón rojizo a temperatura ambiente que emite vapores que son corrosivos y tóxicos.
El bromo líquido no se presenta de forma natural sino que aparece como una sustancia incolora y cristalina.
Si alguna vez te has preguntado para qué sirve el bromo, a continuación tienes una lista de sus posibles usos:
- El mayor uso de bromo es la creación de retardantes de llama. Cuando cuando esta sustancia se quema el bromo aisla el fuego del oxígeno causando que este se apague.
- Los compuestos de bromuro, en particular el bromuro de potasio, se utilizan en los círculos médicos como anticonvulsivos. También se utilizan los veterinarios. La mayoría de los países limitan seriamente el uso y la disponibilidad de las sales de bromo para uso humano debido al hecho de que causan disfunciones neurológicas.
- Las sustancias bromadas son ingredientes importantes de muchos medicamentos de venta libre y medicamentos con receta, como analgésicos, sedantes y los antihistamínicos. De hecho, los compuestos de bromo son los ingredientes activos en varios medicamentos que tratan la neumonía y la adicción a la cocaína. Actualmente, los medicamentos que contienen varios compuestos de bromo están en ensayos para el tratamiento de la enfermedad de Alzheimer y las nuevas generaciones de la lucha contra el cáncer y medicamentos contra el SIDA.
- El bromuro procedente del calcio, sodio y zinc se utiliza para crear soluciones especiales para la perforación de sal.
- El bromo se utiliza para crear aceites vegetales bromados que se utilizan como emulsiona en algunas marcas de bebidas gaseosas.
- A menudo se utiliza en el mantenimiento de las piscinas en particular en los baños termales.
- Se utiliza en la purificación del aguas industriales, desinfectantes e insecticidas.
- El bromo se utiliza para reducir la contaminación por mercurio de las plantas eléctricas de carbón. Esto se puede lograr ya sea por tratamiento de carbón activado con bromo o mediante la inyección de compuestos de bromo sobre el carbón antes de su combustión.
- También se utiliza para crear diferentes tintes de color en la industria textil.
- También se está probando en baterías para coches eléctricos para ayudar que los coches eléctricos produzcan cero emisiones.
- El bromo etileno se ha utilizado como un aditivo de la gasolina, al igual que el plomo previene la degradación del motor. La combinación de plomo y bromo es altamente contaminante y se expulsa del motor a través del tubo de escape. Este uso de bromo tiene declive desde la década de 1970 debido a las preocupaciones ambientales.
- El bromo metilo se utiliza como plaguicida altamente tóxico para fumigar el suelo y la vivienda utilizando el método de tienda de campaña. Ya no se utiliza de esta manera ya que es una sustancia que agota el ozono y se ha sustituido por otros productos químicos menos nocivos.
Propiedades del azufre
Una de las propiedades de los
elementos no metales como el azufre es por ejemplo que los elementos no
metales son malos conductores del calor y la electricidad.
El azufre, al igual que los demás elementos no metales, no tiene lustre.
Debido a su fragilidad, los no metales como el azufre, no se pueden
aplanar para formar láminas ni estirados para convertirse en hilos.
El estado del azufre en su forma natural es sólido.
El azufre es un elmento químico de aspecto amarillo limón y pertenece al grupo de los no metales.
El número atómico del azufre es 16.
El símbolo químico del azufre es S.
El punto de fusión del azufre es de 388,36 grados Kelvin o de 116,21 grados celsius o grados centígrados.
El punto de ebullición del azufre es de 717,87 grados Kelvin o de 445,72 grados celsius o grados centígrados.
Usos del azufre
El azufre, es un sólido cristalino amarillo brillante, que es esencial para la vida.
Si alguna vez te has preguntado para qué sirve el azufre, a continuación tienes una lista de sus posibles usos:
- La mayoría de azufre se convierte en ácido sulfúrico. El ácido sulfúrico es extremadamente importante para muchas industrias de todo el mundo. Se utiliza en la fabricación de fertilizantes, refinerías de petróleo, tratamiento de aguas residuales, baterías de plomo para automóviles, extracción de mineral, eliminación de óxido de hierro, fabricación de nylon y producción de ácido clorhídrico.
- El azufre puede ser utilizado como un pesticida y fungicida. Muchos agricultores que cultivan alimentos orgánicos usan azufre como un pesticida natural y fungicida.
- El sulfato de magnesio, que contiene azufre, se utiliza como laxante, en sales de baño y como un suplemento de magnesio para las plantas.
- El azufre es importante para la vida. Por lo tanto, se añade a los fertilizantes (en forma soluble) para que las plantas tengan más azufre disponible en el suelo.
- El disulfuro de carbono, un compuesto de azufre, se puede utilizar para hacer celofán y rayón (un material utilizado en la ropa).
- El azufre se utiliza para vulcanizar caucho. La vulcanización de goma hace más difícil. Se asegura que el caucho mantiene su forma. El caucho vulcanizado se utiliza para fabricar neumáticos del coche, suelas de zapatos, mangueras y discos de hockey sobre hielo.
- Otros compuestos de azufre (sulfitos) se utilizan para blanquear el papel y preservar la fruta.
- El azufre es también un componente de la pólvora.
Propiedades del nitrógeno
Una de las propiedades de los
elementos no metales como el nitrógeno es por ejemplo que los elementos
no metales son malos conductores del calor y la electricidad.
El nitrógeno, al igual que los demás elementos no metales, no tiene
lustre.
Debido a su fragilidad, los no metales como el nitrógeno, no se pueden
aplanar para formar láminas ni estirados para convertirse en hilos.
El estado del nitrógeno en su forma natural es gaseoso.
El nitrógeno es un elmento químico de aspecto incoloro y pertenece al grupo de los no metales.
El número atómico del nitrógeno es 7.
El símbolo químico del nitrógeno es N.
El punto de fusión del nitrógeno es de 63,14 grados Kelvin o de -209,01 grados celsius o grados centígrados.
El punto de ebullición del nitrógeno es de 77,35 grados Kelvin o de -194,8 grados celsius o grados centígrados.
Usos del nitrógeno
El nitrógeno es un gas incoloro, inodoro, insípido e inerte por lo general (no reactivo).
Si alguna vez te has preguntado para qué sirve el nitrógeno, a continuación tienes una lista de sus posibles usos:
- El nitrógeno se utiliza para conservar los alimentos envasados al detener la oxidación de los alimentos que hace que se estropeen.
- Las bombillas pueden contener nitrógeno como una alternativa más barata al argón.
- El gas nitrógeno se utiliza a menudo en la parte superior de los explosivos líquidos para evitar que se detonen.
- El nitrógeno se usa para producir muchas piezas eléctricas tales como transistores, diodos y circuitos integrados.
- Cuando se seca y se presuriza, el gas nitrógeno se usa como un gas dieléctrico para equipos de alta tensión.
- Se utiliza para la fabricación de acero inoxidable.
- Se utiliza para reducir el riesgo de incendio en los sistemas militares de combustible de la aeronave.
- El gas nitrógeno se utiliza para rellenar los neumáticos de los aviones y los automóviles (coches). Sin embargo, los vehículos comerciales suelen usar aire normal.
- Los tanques de nitrógeno están sustituyendo gradualmente a los tanques de dióxido de carbono como fuente de alimentación de pistolas de paintball.
- También puede utilizarse como una alternativa al dióxido de carbono en la presurización de cerveza. El gas nitrógeno que hace burbujas más pequeñas por lo que la cerveza es más suave.
- El nitrógeno líquido se utiliza para la conservación (llamado criopreservación, debido a la baja temperatura) de la sangre y otras muestras biológicas. También se utiliza para enfriar los detectores de rayos X y las unidades centrales de procesamiento en los ordenadores cuando están calientes.
- El nitrógeno es un componente de casi todas las drogas farmacológicas. El gas de la risa (óxido nitroso) se puede utilizar como un anestésico.
lunes, 13 de abril de 2015
Propiedades del oxígeno
Una de las propiedades de los
elementos no metales como el oxígeno es por ejemplo que los elementos no
metales son malos conductores del calor y la electricidad.
El oxígeno, al igual que los demás elementos no metales, no tiene
lustre.
Debido a su fragilidad, los no metales como el oxígeno, no se pueden
aplanar para formar láminas ni estirados para convertirse en hilos.
El estado del oxígeno en su forma natural es gaseoso (paramagnético).
El oxígeno es un elmento químico de aspecto incoloro y pertenece al grupo de los no metales.
El número atómico del oxígeno es 8.
El símbolo químico del oxígeno es O.
El punto de fusión del oxígeno es de 50,35 grados Kelvin o de -221,8 grados celsius o grados centígrados.
El punto de ebullición del oxígeno es de 90,18 grados Kelvin o de -181,97 grados celsius o grados centígrados.
Usos del oxígeno
El oxígeno es un elemento químico importante que es. Incoloro, inodoro e insípido.
Si alguna vez te has preguntado para qué sirve el oxígeno, a continuación tienes una lista de sus posibles usos:
- Obviamente, el oxígeno es importante para la respiración humana. Por lo tanto, la terapia de oxígeno se utiliza para las personas que tienen dificultad para respirar debido a alguna condición médica (como enfisema o neumonía).
- El oxígeno gaseoso es venenoso para las bacterias que causan gangrena. Por lo tanto, se utiliza para matarlos.
- El envenenamiento por monóxido de carbono se trata con gas oxígeno.
- En los trajes espaciales se utiliza oxígeno de un alto grado de pureza para que los astronautas pueden respirar. Los tanques de buceo también contienen oxígeno, aunque por lo general se mezcla con aire normal.
- Los aviones y los submarinos también cuentan con bombonas de oxígeno (para emergencias).
- El oxígeno se utiliza en la producción de polímeros de poliéster y los anticongelantes. Los polímeros se utilizan para hacer plástico y telas.
- Los cohetes usan el oxígeno para quemar el combustible líquido y generar sustentación.
- La mayoría de oxígeno producido comercialmente se utiliza para convertir el mineral de hierro en acero.
- Los científicos usan la proporción de dos isótopos de oxígeno (oxígeno-18 y oxígeno-16) en los esqueletos para investigar el clima de hace miles de años.
- El oxígeno puro se utiliza para asegurar la combustión completa de los productos químicos.
- El oxígeno se utiliza para tratar el agua, y también para cortar y soldar metales.
Una de las propiedades de los
elementos no metales como el carbono es por ejemplo que los elementos no
metales son malos conductores del calor y la electricidad.
El carbono, al igual que los demás elementos no metales, no tiene
lustre.
Debido a su fragilidad, los no metales como el carbono, no se pueden
aplanar para formar láminas ni estirados para convertirse en hilos.
- El grafito, una forma de carbono, se combina con arcilla para hacer el principal componente de los lápices. El grafito se utiliza también como un electrodo en la electrólisis, ya que es inerte (no reacciona con otros productos químicos).
- El grafito se utiliza también como lubricante, como pigmento, como un material de moldeo en la fabricación de vidrio y como moderador de neutrones en los reactores nucleares.
- El carbón, otra forma de carbono, se utiliza en obras de arte y para asar a la parrilla (por lo general en una barbacoa). El carbón activado (otra forma de carbono) se utiliza como un absorbente o adsorbente en muchos filtros. Estos incluyen máscaras de gas, purificadores de agua y campanas extractoras de cocina. También puede ser utilizada en medicina para eliminar toxinas, gases o venenos del sistema digestivo, por ejemplo en los lavados de estómago.
- El diamante es otra forma de carbono que se utilizan en joyería. Los diamantes industriales se utilizan para perforar, cortar o pulir metales y piedra.
- El carbono, en forma de coque, se utiliza para reducir el mineral de hierro en el metal de hierro.
- Cuando se combina con el silicio, tungsteno, boro y titanio, el carbono forma algunos de los compuestos más duros conocidos. Estos se utilizan como abrasivos en herramientas de corte y esmerilado.
miércoles, 25 de marzo de 2015
Metal
Se denomina metal a los elementos químicos caracterizados por ser buenos conductores del calor y la electricidad. Poseen alta densidad y son sólidos en temperaturas normales (excepto el mercurio); sus sales forman iones electropositivos (cationes) en disolución.
La ciencia de materiales define un metal como un material en el que existe un solapamiento entre la banda de valencia y la banda de conducción en su estructura electrónica (enlace metálico). Esto le da la capacidad de conducir fácilmente calor y electricidad,(tal
como el cobre) y generalmente la capacidad de reflejar la luz, lo que
le da su peculiar brillo. En ausencia de una estructura electrónica
conocida, se usa el término para describir el comportamiento de aquellos
materiales en los que, en ciertos rangos de presión y temperatura, la conductividad eléctrica disminuye al elevar la temperatura, en contraste con los semiconductores.
No metal
Se denomina no metales, a los elementos químicos opuestos a los metales pues sus características son totalmente diferentes. Los no metales, excepto el hidrógeno, están situados en la tabla periódica de los elementos en el bloque p. Los elementos de este bloque son no-metales, excepto los metaloides (B, Si, Ge, As, Sb, Te), todos los gases nobles (He, Ne, Ar, Kr, Xe, Rn), y algunos metales (Al, Ga, In, Tl, Sn, Pb).
Compuestos quimicos
Los Compuesto Químicos están
formados por un mínimo de 2 elementos que han reaccionado entre si para dar
otra sustancia diferente a los elementos iniciales (reacción química). Vamos a
explicar todo esto mejor.
Empecemos por definir lo que es un elemento. Es aquella materia que está formada por átomos todos iguales. Por ejemplo un trozo de hierro puro al verlo al microscopio, solo veremos átomos de Fe (hierro), eso quiere decir que es una sustancia pura y además simple, o lo que es lo mismo que el Fe es un elemento. Existen 144 elementos conocidos en el universo, agrupados en la tabla periódica de los elementos.
Los compuestos químicos están formados por un mínimo de 2 elementos que han reaccionado entre si para dar otra sustancia diferente a los elementos (reacción química, que se puede conseguir con un reactor químico). Si no hubieran reaccionada formarían una mezcla (homogénea o heterogénea y no es el caso). Según lo dicho los compuestos químicos tienen átomos (de cada elemento) agrupados o lo que se llama moléculas. Por ejemplo si hacemos que reaccionen 2 átomos de hidrógeno con 1 de oxigeno, obtendríamos un compuesto químico llamado agua H2O.
Empecemos por definir lo que es un elemento. Es aquella materia que está formada por átomos todos iguales. Por ejemplo un trozo de hierro puro al verlo al microscopio, solo veremos átomos de Fe (hierro), eso quiere decir que es una sustancia pura y además simple, o lo que es lo mismo que el Fe es un elemento. Existen 144 elementos conocidos en el universo, agrupados en la tabla periódica de los elementos.
Los compuestos químicos están formados por un mínimo de 2 elementos que han reaccionado entre si para dar otra sustancia diferente a los elementos (reacción química, que se puede conseguir con un reactor químico). Si no hubieran reaccionada formarían una mezcla (homogénea o heterogénea y no es el caso). Según lo dicho los compuestos químicos tienen átomos (de cada elemento) agrupados o lo que se llama moléculas. Por ejemplo si hacemos que reaccionen 2 átomos de hidrógeno con 1 de oxigeno, obtendríamos un compuesto químico llamado agua H2O.
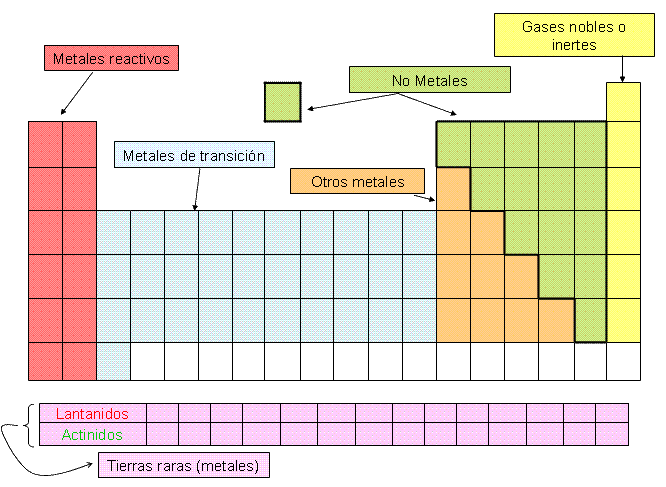
Como se distribuyen los elementos en la tabla periodica
Los elementos están distribuidos en filas
(horizontales) denominadas períodos y se enumeran del 1 al 7 con números
arábigos. Los elementos de propiedades similares están reunidos en
columnas (verticales), que se denominan grupos o familias; los cuales
están identificados con números romanos y distinguidos como grupos A y
grupos B. Los elementos de los grupos A se conocen como elementos
representativos y los de los grupos B como elementos de transición. Los
elementos de transición interna o tierras raras se colocan aparte en la
tabla periódica en dos grupos de 14 elementos, llamadas series lantánida
y actínida.
La tabla periódica permite clasificar a los elementos en metales, no metales y gases nobles. Una línea diagonal quebrada ubica al lado izquierdo a los metales y al lado derecho a los no metales. Aquellos elementos que se encuentran cerca de la diagonal presentan propiedades de metales y no metales; reciben el nombre de metaloides.
Metales:Son buenos conductores del calor y la electricidad, son maleables y dúctiles, tienen brillo característico.
La tabla periódica permite clasificar a los elementos en metales, no metales y gases nobles. Una línea diagonal quebrada ubica al lado izquierdo a los metales y al lado derecho a los no metales. Aquellos elementos que se encuentran cerca de la diagonal presentan propiedades de metales y no metales; reciben el nombre de metaloides.
Metales:Son buenos conductores del calor y la electricidad, son maleables y dúctiles, tienen brillo característico.
No Metales:Pobres conductores del calor y la electricidad, no poseen brillo, no son maleables ni dúctiles y son frágiles en estado sólido.
Historia de la tabla periodica
La
Tabla Periódica es un importantísimo recurso que utilizan los químicos
para poder acceder a todas las características y propiedades físicas y
químicas de todos los elementos conocidos.
Desde sus inicios
hasta la actualidad, la tabla periódica ha estado en constante cambio y
evolución. A mediados del siglo XIX ya se conocían 55 elementos sin
ninguna relación aparente; Johann Döbereiner (1789 - 1849) fue el
primer científico que comenzó a ordenarlos y logró agruparlos en tríadas
(3 elementos), en las que el peso atómico del elemento central era
casi el promedio de los otros dos.
Posteriormente, Alexander
Newlands (1838 - 1889) ordenó los elementos conocidos por sus masas
atómicas crecientes y observó que después de cada siete elementos el
octavo repetía las propiedades químicas del primero, lo que llamó Ley
de las Octavas.
En 1781, Dimitri Ivanovich Mendeleiev (1834 -
1907) ordenó los 63 elementos conocidos para ese entonces, por su peso
atómico. A dicha clasificación la llamó la tabla Periódica, nombre con
el que se conoce hasta la actualidad, en ella demostró que las
propiedades de los elementos variaban de manera periódica en función de
su número atómico.
La Tabla Periódica en sí misma será una guía indispensable para toda persona que esté relacionada con la Química.
Cronología de las diferentes clasificaciones de los elementos químicos
Döbereiner
Este
químico alcanzó a elaborar un informe que mostraba una relación entre
la masa atómica de ciertos elementos y sus propiedades en 1817. Él
destaca la existencia de similitudes entre elementos agrupados en tríos
que él denomina “tríadas”. La tríada del cloro, del bromo y del yodo
es un ejemplo. Pone en evidencia que la masa de uno de los tres
elementos de la triada es intermedia entre la de los otros dos. En 1850
pudimos contar con unas 20 tríadas para llegar a una primera
clasificación coherente.
Chancourtois y Newlands
En
1862 Chancourtois, geólogo francés, pone en evidencia una cierta
periodicidad entre los elementos de la tabla. En 1864 Chancourtois y
Newlands, químico inglés, anuncian la Ley de las octavas: las
propiedades se repiten cada ocho elementos. Pero esta ley no puede
aplicarse a los elementos más allá del Calcio. Esta clasificación es por lo tanto insuficiente, pero la tabla periódica comienza a ser diseñada.
Meyer
En
1869, Meyer, químico alemán, pone en evidencia una cierta periodicidad
en el volumen atómico. Los elementos similares tienen un volumen atómico
similar en relación con los otros elementos. Los metales alcalinos
tienen por ejemplo un volumen atómico importante.
Mendeleïev
En
1869, Mendeleïev, químico ruso, presenta una primera versión de su
tabla periódica en 1869. Esta tabla fue la primera presentación
coherente de las semejanzas de los elementos. El se dio cuenta de que
clasificando los elementos según sus masas atómicas se veía aparecer una
periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.
La tabla de Mendeleïev condujo a la tabla periódica actualmente utilizada.
Un grupo de la tabla periódica es una columna vertical de la tabla. Hay
18 grupos en la tabla estándar. El hecho de que la mayoría de estos
grupops correspondan directamente a una serie químmica no es fruto del
azar. La tabla ha sido inventada para organizar las series químicas
conocidas dentro de un esquema coherente. La distribución de los
elementos en la tabla periódica proviene del hecho de que los elementos
de un mismo grupo poseen la misma configuración electrónica en su capa
más externa. Como el comportamiento químico está principalmente dictado
por las interacciones de estos electrones de la última capa, de aquí el
hecho de que los elementos de un mismo grupo tengan similares
propiedades físicas y químicas.
Suscribirse a:
Comentarios (Atom)